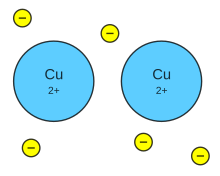
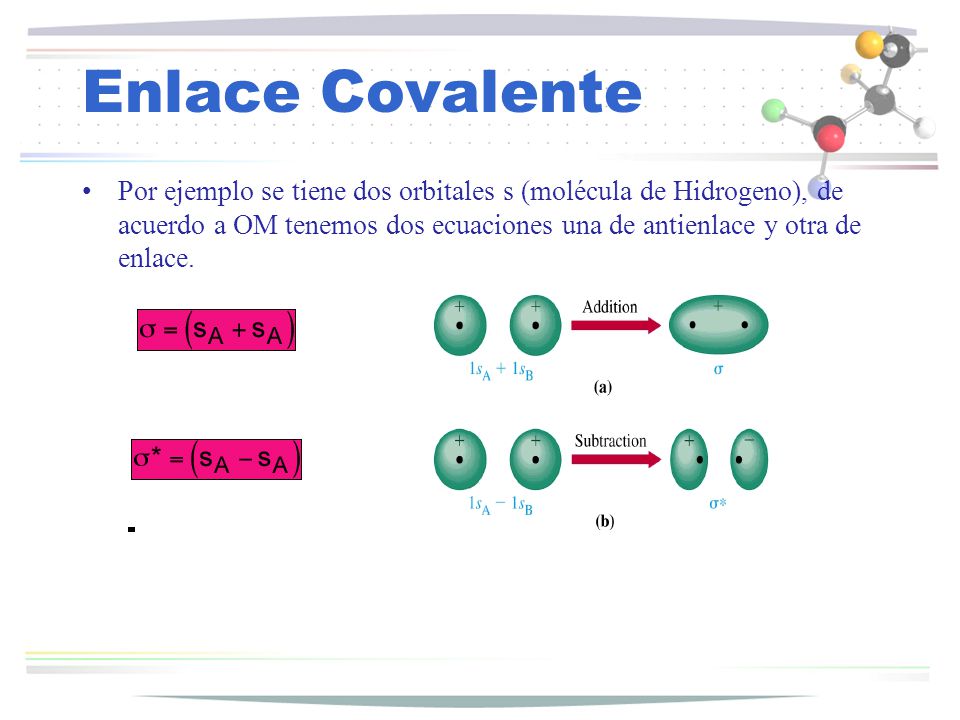
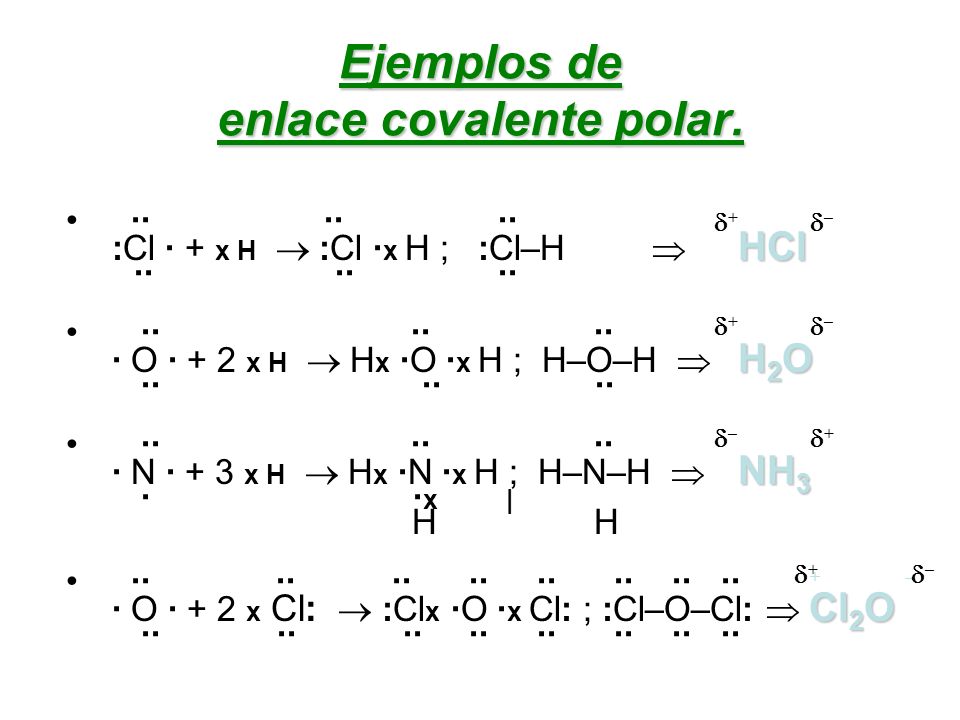
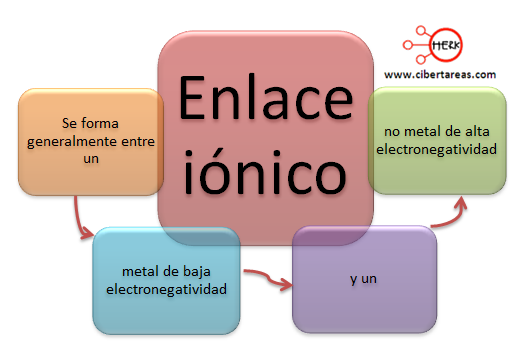
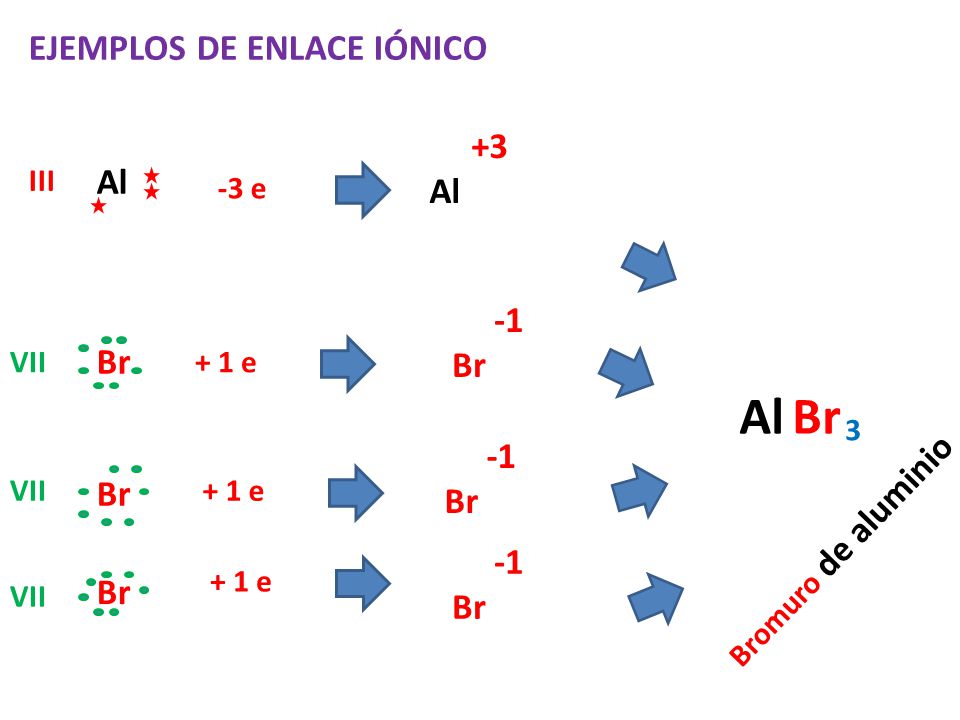
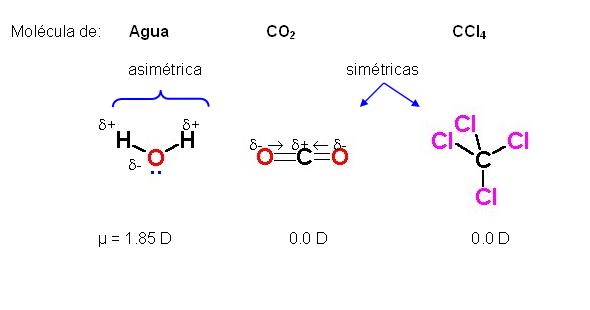
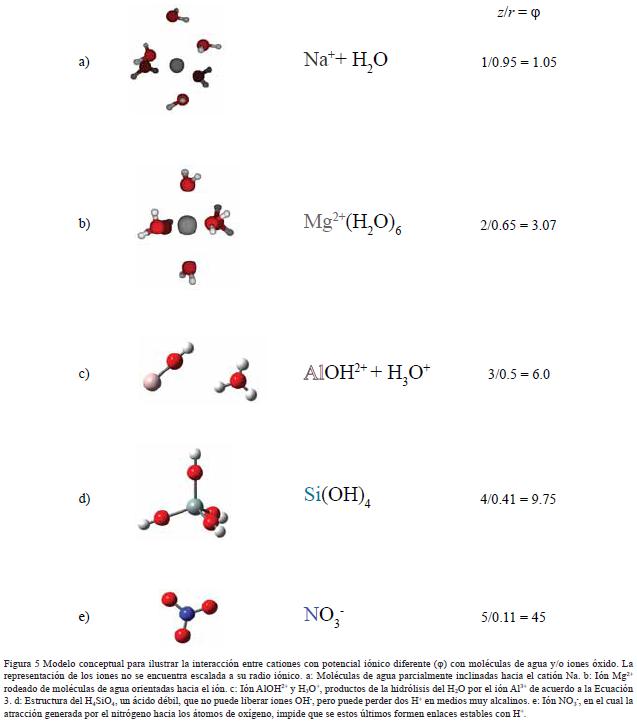
Dentro de una molécula, los átomos están unidos mediante fuerzas intramoleculares (enlaces iónicos, metálicos o covalentes, principalmente). Estas son las fuerzas que se deben vencer para que se produzca un cambio químico. Son estas fuerzas, por tanto, las que determinan las propiedades químicas de las sustancias.
Sin embargo existen otras fuerzas intermoleculares que actúan sobre distintas moléculas o iones y que hacen que éstos se atraigan o se repelan. Estas fuerzas son las que determinan las propiedades físicas de las sustancias como, por ejemplo, el estado de agregación, el punto de fusión y de ebullición, la solubilidad, la tensión superficial, la densidad, etc.
Por lo general son fuerzas débiles pero, al ser muy numerosas, su contribución es importante. La figura inferior resume los diversos tipos de fuerzas intermoleculares. Pincha en los recuadros para saber más sobre ellas.
EJEMPLOS:




https://www.google.com.mx/url?sa=t&rct=j&q=&esrc=s&source=video&cd=1&cad=rja&uact=8&ved=0ahUKEwiLv8LCiZ3QAhWEJiYKHcogD9EQtwIIHDAA&url=https%3A%2F%2Fwww.youtube.com%2Fwatch%3Fv%3DBdkZyA4rvXc&usg=AFQjCNFO9plBAlLe78u8ErOwP3hq75A2PA&sig2=-INwYODm6JQ9xpgx3vKMdA
Opinion
Los enlaces Intermoleculares son cuando las ,moleculas cambian ,Por que nos ayudan a saver si pueden conservarse como son O no
Antonio Miguel Basto Carrillo
Opinion
Los enlaces Intermoleculares son cuando las ,moleculas cambian ,Por que nos ayudan a saver si pueden conservarse como son O no
Antonio Miguel Basto Carrillo